صدفتان من الحجم نفسه
كوبان شفافان ماء
خل أبيض
في هذه التجربة، ستحتاج إلى كمية من الخل تكفي لملء نصف كوب من الكوبين. يلزم الحجم نفسه من الماء لمطابقة كمية الخل.
ابحث عن صدفتين صغيرتين متشابهين في الشكل والحجم. سيساعدك هذا على مقارنة التغيرات بعد التجربة. حلّل الصدفتين مسبقاً ولاحظ مظهرهما.

خصص صدفة واحدة لكل كوب، والتي ستُخضع لظروف مختلفة. يستحسن أن تكتب على أحد الكوبين ”خل“ وعلى الآخر ”ماء“ للمتابعة.
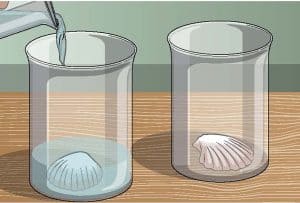
خذ الماء واسكبه في أحد الكوبين بحيث يمتلئ حتى نصفه – أو على الأقل حتى تُغمر الصدفة بكاملها. ويمثل هذا وجود الصدفة في المحيط، لكن إذا كنت تعيش بالقرب من البحر، يمكنك أيضاً استخدام عينة من مياه البحر الحقيقية.
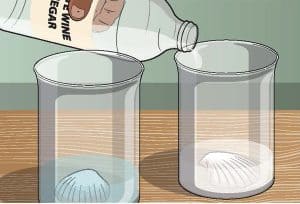
في الكوب الثاني، اسكب الحجم نفسه من الخل. هذا ”المحيط“ أكثر حمضية بكثير، حيث يبلغ مستوى الأس الهيدروجيني pH فيه نحو .2.5
ماذا يحدث بمجرد تغطية الصدفة بالخل؟ إذا نظرت عن كثب، سيبدأ سطحها يفور وتنبعث عنه فقاعات.

بعد يوم أو حتى بضعة أيام، لا ينبغي أن يتغير مظهر الصدفة في الماء كثيراً. سجّل كيف تبدو بعد بضع ساعات، وبعد يوم، وهلم جرا.
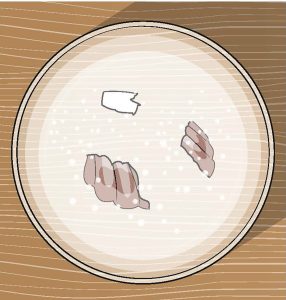
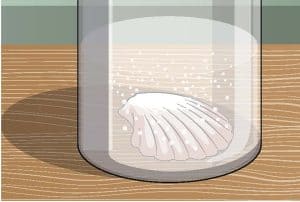
ماذا يحدث للصدفة في الخل بعد بضع ساعات، وبعد يوم وبضعة أيام؟ ستتمكن من رؤية تدهور طفيف، حيث تذوب الصدفة في النهاية ويتعكر الخل مع تلاشيها بالكامل.
تتكون الصدفتان في هذه التجربة من كربونات الكالسيوم Calcium carbonate. يتفاعل حمض الخليك Acetic acid الموجود في الخل مع الصدفة لتفتيت كربونات الكالسيوم، مكوناً فقاعات من ثاني أكسيد الكربون. ينبعث هذا الغاز من الكربونات، في حين يُطلق الكالسيوم في الماء. هذه العملية غير ضارة عندما تُحتوى داخل كوب صغير، لكن ماذا لو حدث ذلك على نطاق واسع كالمحيط؟ مع إطلاق المزيد من ثاني أكسيد الكربون في الغلاف الجوي عن طريق الاحترار العالمي، يزداد تركيز الغاز المذاب في مياه المحيطات. يقلل هذا من درجة حموضة الماء بمرور الزمن، مما يعني أنه يكون أكثر حمضية.
بالنسبة إلى الكائنات البحرية التي تعتمد على هذه الأصداف كمنازل لها، تتسبب التغيرات الجذرية في حموضة المحيطات بعواقب وخيمة على معدلات بقائها. مثلما أضعف الخل صدفتك حتى تلاشت في النهاية داخل الكوب، فإن منازل هذه الحيوانات ببساطة لن تتمكن من الوجود في ظل الظروف الشديدة الحموضة.
هل جربتها بنفسك؟
دعنا نعرف!
إذا جرّبت أيّاً من تجاربنا- أو نفّذت بعضها- فأخبرنا بذلك! شاركنا بالصور أو مقاطع الفيديو على وسائل التواصل الاجتماعي!
إخلاء المسؤولية
لا تتحمل التقدم العلمي للنشر ولا أيّ من موظفيها المسؤولية عن أي أضرار قد تتعرض لها أثناء تنفيذ هذه المشاريع. عليك دائماً اتخاذ جانب الحيطة والحذر عند تشغيل المعدات التي يُحتمل أن تكون خطرة أو عند العمل مع الإلكترونيات، واتبع تعليمات الشركة المصنِّعة.


